Công thức HNO3 thể hiện sự kết hợp giữa hydro, nitơ và oxy trong một axit có tính oxi hóa mạnh. Đây là một hợp chất quen thuộc trong phòng thí nghiệm và công nghiệp, với nhiều đặc điểm hóa học nổi bật. Bài viết do sackolik biên soạn sẽ giúp bạn hiểu rõ hơn về cấu tạo, tính chất và ứng dụng của HNO3.
Giới thiệu chung về công thức HNO3
HNO3, còn gọi là axit nitric, là một hợp chất vô cơ quan trọng trong hóa học. Đây là một axit mạnh, có thể phân ly hoàn toàn khi hòa tan trong nước. Công thức HNO3 tồn tại ở dạng lỏng, không màu khi tinh khiết nhưng dễ chuyển sang màu vàng nhạt do phân hủy tạo NO2.

Axit nitric có tính ăn mòn cao và phản ứng mạnh với nhiều kim loại, phi kim và hợp chất hữu cơ. Nhờ đặc tính này, nó thường được sử dụng trong nhiều lĩnh vực công nghiệp. Trong phòng thí nghiệm, công thức HNO3 là một hóa chất phổ biến để điều chế các muối nitrat.
Tuy có nhiều ứng dụng, nhưng HNO3 cũng tiềm ẩn nhiều nguy hiểm nếu không được sử dụng và bảo quản đúng cách. Tiếp xúc trực tiếp có thể gây bỏng da, tổn thương hô hấp hoặc ăn mòn vật liệu. Vì vậy, khi học về HNO3 trong chương trình lớp 10, học sinh cũng cần nắm rõ các quy tắc an toàn khi thí nghiệm.
Công thức hóa học và cấu tạo phân tử của HNO3
HNO3 là một hợp chất vô cơ quan trọng với cấu trúc đặc trưng tạo nên nhiều tính chất hóa học đáng chú ý. Việc phân tích công thức và cấu tạo phân tử giúp giải thích rõ ràng tại sao HNO3 lại có tính axit mạnh và khả năng oxi hóa cao.
Công thức phân tử HNO3
Công thức HNO3 là viết tắt của axit nitric, gồm một nguyên tử hidro, một nguyên tử nitơ và ba nguyên tử oxi. Đây là công thức hóa học phản ánh đúng tỷ lệ các nguyên tố cấu thành trong một phân tử. Mặc dù đơn giản về mặt biểu diễn, nó là nền tảng để tạo nên hàng loạt phản ứng mạnh trong hóa học vô cơ. Đặc điểm này cũng cho thấy mức độ ổn định tương đối trong điều kiện thường.
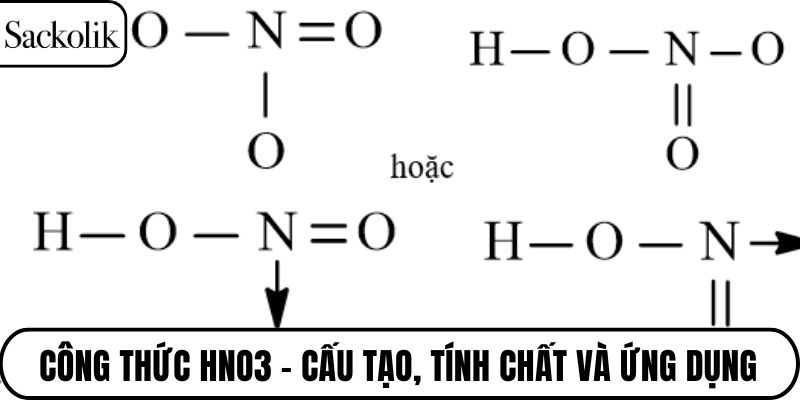
Cấu tạo phân tử và liên kết của công thức HNO3
Cấu trúc phân tử của công thức HNO3 thể hiện sự liên kết giữa nitơ với ba nguyên tử oxi và một nhóm OH. Các liên kết chính gồm N=O (kép), N–OH (đơn) và liên kết phối trí N→O⁻, trong đó nitơ đóng vai trò trung tâm. Sự phân bố điện tích không đều làm phân tử có tính phân cực mạnh. Chính điều này góp phần vào khả năng phản ứng nhanh và mạnh với nhiều chất.

Dạng ion hóa trong dung dịch
Khi tan trong nước, HNO3 phân ly hoàn toàn theo phương trình: HNO3 → H⁺ + NO3⁻. Sự phân ly này cho thấy HNO3 là một axit mạnh, gần như không tồn tại dưới dạng phân tử trong dung dịch. NO3⁻ là một ion bền, không bị thủy phân ngược lại. Tính chất này giúp HNO3 phản ứng dễ dàng trong các phản ứng axit–bazơ.
Ý nghĩa cấu trúc với tính chất hóa học
Cấu trúc giàu oxi, cùng liên kết phối trí và nhóm nitrat, tạo điều kiện cho HNO3 có khả năng oxi hóa rất mạnh. Nó không chỉ đóng vai trò là axit mà còn là chất oxi hóa trong nhiều phản ứng. Các liên kết linh hoạt giữa nitơ và oxi cho phép HNO3 tấn công nhiều chất khử. Nhờ đó, nó thường dùng trong điều chế muối, xử lý kim loại và phản ứng oxi hóa đặc biệt.
So sánh với các axit khác
Nếu so với H2SO4 hay HCl, công thức HNO3 có cấu trúc phức tạp hơn do chứa nhóm NO3 có tính linh động. Mặc dù tất cả đều là axit mạnh, HNO3 nổi bật với khả năng oxi hóa đặc trưng mà HCl không có. H2SO4 cũng là chất oxi hóa nhưng thường cần điều kiện đặc biệt hơn. Vì vậy, HNO3 giữ vai trò trung gian giữa tính axit và tính oxi hóa mạnh trong nhiều ứng dụng.
Tính chất vật lý và hóa học của công thức HNO3
HNO3 là một trong những axit vô cơ phổ biến và có nhiều đặc tính nổi bật. Việc tìm hiểu tính chất vật lý và hóa học của HNO3 giúp làm rõ vì sao chất này lại có vai trò quan trọng trong cả phòng thí nghiệm lẫn công nghiệp.
Tính chất vật lý
Công thức HNO3 là chất lỏng không màu, mùi hăng và dễ bay hơi ở điều kiện thường. Khi tiếp xúc với không khí hoặc ánh sáng, nó có thể chuyển sang màu vàng nhạt do bị phân hủy tạo thành khí NO2. Axit này tan rất tốt trong nước, tạo thành dung dịch axit mạnh. Dung dịch HNO3 đặc còn có khả năng bốc khói trong không khí ẩm.
Tính axit mạnh
Công thức HNO3 là axit đơn chức, phân ly hoàn toàn trong nước theo phương trình HNO3 → H⁺ + NO3⁻. Nhờ khả năng phân ly mạnh, nó dễ dàng phản ứng với bazơ, oxit bazơ và muối để tạo ra muối nitrat và nước. Tính axit mạnh còn giúp HNO3 tham gia nhiều phản ứng trung hòa có ý nghĩa thực tiễn. Ngoài ra, độ pH của dung dịch HNO3 loãng thường rất thấp.

Tính oxi hóa mạnh
Không chỉ là một axit mạnh, công thức HNO3 còn là chất oxi hóa mạnh do nguyên tử nitơ mang số oxi hóa +5. Nó có thể oxi hóa nhiều kim loại (như Cu, Ag), phi kim (như C, S) và hợp chất có tính khử. Trong quá trình đó, HNO3 bị khử tạo thành các sản phẩm như NO, NO2 hoặc thậm chí là N2O. Tính oxi hóa này làm cho HNO3 khác biệt so với nhiều axit vô cơ khác.
Phản ứng với kim loại
HNO3 có khả năng phản ứng với hầu hết kim loại, kể cả một số kim loại không phản ứng với HCl hoặc H2SO4 loãng. Tuy nhiên, phản ứng không giải phóng khí H2 mà tạo thành khí nitơ oxit như NO, NO2 tùy điều kiện. Với kim loại hoạt động mạnh và axit loãng, sản phẩm thường là NO; còn với axit đặc, thường tạo NO2 màu nâu đỏ. Một số kim loại như Au, Pt vẫn trơ với HNO3 đơn lẻ và chỉ tan trong nước cường toan.
Phân hủy bởi nhiệt và ánh sáng
Công thức HNO3 không bền dưới ánh sáng hoặc khi gặp nhiệt độ cao, dễ bị phân hủy thành NO2, O2 và H2O. Hiện tượng này thường làm axit chuyển sang màu vàng hoặc nâu nhạt nếu để lâu ngoài không khí. Vì lý do này, HNO3 cần được bảo quản trong chai tối màu và nơi mát. Quá trình phân hủy cũng là minh chứng cho tính oxi hóa mạnh và độ nhạy cảm của hợp chất này.
Xem thêm: Công Thức NaCl Trong Hóa Học Và Đời Sống Hàng Ngày
Ứng dụng và lưu ý khi sử dụng công thức HNO3
Axit HNO3 được sử dụng rộng rãi trong nhiều lĩnh vực nhờ tính chất hóa học đặc trưng. Sackolik sẽ cung cấp cho người đọc cái nhìn cụ thể hơn về các ứng dụng thực tiễn và những điều cần lưu ý khi làm việc với hợp chất này.
- Sản xuất phân bón: HNO3 là nguyên liệu chính để tạo ra các loại phân đạm như amoni nitrat (NH4NO3). Loại phân này có tác dụng cung cấp nitơ cho cây trồng, giúp tăng năng suất nông nghiệp.
- Công nghiệp chất nổ và hóa chất: HNO3 tham gia vào quá trình sản xuất thuốc nổ như TNT hoặc nitroglycerin. Đồng thời, nó cũng được dùng trong chế tạo thuốc nhuộm, chất tẩy rửa và các hợp chất hữu cơ khác.
- Sử dụng trong phòng thí nghiệm: Trong phòng thí nghiệm, công thức HNO3 được dùng để điều chế muối nitrat thông qua phản ứng với bazơ hoặc kim loại. Nó cũng đóng vai trò trong các phản ứng phân tích hóa học.
- Bảo quản và vận chuyển: HNO3 phải được chứa trong chai thủy tinh tối màu, đậy kín và để nơi thoáng mát, tránh ánh sáng. Khi tiếp xúc, cần sử dụng dụng cụ chuyên dụng bằng vật liệu không phản ứng với axit.
- Tác động đến sức khỏe và môi trường: Hít phải hơi HNO3 hoặc tiếp xúc trực tiếp có thể gây bỏng, tổn thương hô hấp và da. Nếu thải ra môi trường mà không xử lý, axit này có thể gây ô nhiễm nước và đất.
Kết luận
Công thức HNO3 không chỉ đại diện cho một hợp chất hóa học đơn thuần, mà còn phản ánh vai trò thiết yếu của axit nitric trong đời sống và nghiên cứu. Việc nắm rõ cấu tạo và tính chất của HNO3 sẽ giúp việc học và ứng dụng trở nên chính xác hơn. Sackolik hy vọng thông tin trên góp phần làm rõ kiến thức bạn đang tìm hiểu.